Prof. Luis Maria Gil-Carcedo García - Prof.a Elisa Gil-Carcedo Sañudo - Prof. Luis Ángel Vallejo Valdezate - Dr. David Herrero Calvo
Fisiopatología de la presbiacusia. Sistema auditivo periférico
Introducción
Dónde, cómo y porqué se establece el deterioro auditivo en el anciano son las preguntas fundamentales que nos planteamos al comienzo de este capítulo. El dónde se conoce bien, aunque existen puntos por dilucidar; el daño ocurre tanto en la región periférica como en la central, es decir, participan todos los estratos del sistema auditivo. El cómo se estudia en este capítulo y en el que le sucede; en ellos se refieren las alteraciones en las distintas localizaciones.
Más difícil de contestar es el porqué. No se puede discernir categóricamente esto desde el momento en que los factores genéticos, la influencia de fármacos y otros tóxicos no farmacológicos, los mecanismos celulares que involucionan con la edad, el ruido laboral, los factores ambientales y las enfermedades asociadas originan una gran disparidad tanto en el momento de aparición como en la profundidad de la sordera en el anciano. La edad es la consideración básica, pero no nos atrevemos a decir que la fundamental; de hecho, etiquetamos como presbiacusia una hipoacusia neurosensorial que empieza a evolucionar alrededor de los sesenta años, pero… ¿no será una neurosensorial genética tardía? ¿Cómo influye en la audición del paciente el haber trabajado con ruido traumatizante o tóxicos laborales? ¿En qué estilo de vida ha transcurrido su existencia? También nos impacta ver cómo algunas personas octogenarias tienen una audición prácticamente normal.
¿Es entonces la edad el factor fundamental?
Puede ser, pero desde luego emparejándola con otros también muy a considerar.
Vamos a centrar el capítulo tratando de contestar a las dos primeras cuestiones, el dónde y el cómo ocurren las alteraciones que originan la involución de la función auditiva en el paciente de edad avanzada, refiriéndonos siempre a las que afectan al sistema auditivo periférico.
En el excelente trabajo de la doctora Rivera,1 en nuestros capítulos de las tres ediciones de Otología2, 3 y 4 y en multitud de publicaciones, este tema se continúa apoyando en la base fundamental de los criterios de Schuknecht.5 Este autor describe cuatro tipos de alteraciones del sistema auditivo periférico que ocasionan presbiacusia, están determinadas por el lugar en que se establece la lesión anatomopatológica. Distingue entre presbiacusia sensorial (tipo 1), neuronal (tipo 2), estrial (tipo 3) y de transmisión coclear (tipo 4). Esta tipificación no está perfectamente individualizada en la práctica, pues en la mayoría de los casos se combinan estos distintos tipos de localización lesional, pero la utilizamos porque su sistematización tiene eficacia didáctica al relacionar el daño con su expresión clínica.
Oímos e interpretamos con el cerebro lo que oímos. Pero el cerebro no tiene capacidad para comprender la realidad tal como es y por ello se vale de los órganos de los sentidos, «ventanas» a través de las cuales puede asomarse al mundo que nos rodea. La ventana que aporta información al cerebro acerca de los sonidos es la cóclea. En ella se convierten las señales acústicas de energía mecánica en impulsos eléctricos capaces de ser interpretados por el sistema nervioso central (SNC). También en la cóclea se discriminan los distintos sonidos según su frecuencia, se codifican los estímulos en el tiempo según su cadencia y se filtran para su mejor comprensión.
Micromecánica coclear. Alteraciones de la función del órgano de corti en el anciano. Prebiacusia sensorial
En la micromecánica coclear, la activación de las células neuroepiteliales CCE y CCI (células ciliadas externas y células ciliadas internas) está ligada a los desplazamientos que sufren sus estereocilios, debidos a la excitación mecánica consecuencia de la onda viajera u onda migratoria. Estos desplazamientos son movimientos de cizallamiento entre las membranas tectoria y basilar.
Con la ondulación de la membrana basilar, el órgano de Corti, que se asienta sobre ella, se ve desplazado sucesivamente arriba y abajo. Este movimiento es más amplio cuanto más externo es el punto de la membrana que se considera. Con estos movimientos, los cilios de las CCE, anclados en la tectoria, se angulan, recuperando luego su posición.
Pero esta hipótesis es válida solo para los cilios de las CCE anclados en la tectoria, no para los de las CCI que no tienen dicho anclaje (figura 1). En la actualidad se admite que los movimientos del órgano de Corti con relación a la membrana tectoria provocan una deformación del espacio subtectorial, que origina corrientes de endolinfa en la superficie del órgano de Corti. Son estas microcorrientes las que ocasionan el movimiento de los cilios de las CCI –que no están unidos a la tectoria–, lo que desencadena la despolarización de la célula; así se origina el fenómeno bioeléctrico (bioacústico), ya que son realmente las CCI las encargadas de transportar la información sonora que ha llegado a la cóclea hasta la primera neurona del nervio coclear.
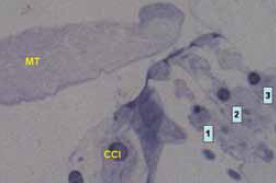
Figura 1.
Órgano de Corti. Se aprecia la membrana tectoria (MT). En las tres hileras de CCE los cilios se unen a la MT (1, 2, 3). Entre la CCI y la MT existe un amplio espacio, los cilios de la CCI no contactan con la MT.
Más del 90% de las fibras aferentes del nervio coclear hacen sinapsis directas con las CCI, mientras que solo la minoría restante contacta con las CCE. Por el contrario, la mayoría de las fibras eferentes terminan en las CCE. Esta distribución de las terminaciones nerviosas nos hace recapacitar aún más acerca de la diferenciada función de las CCE y las CCI. Las CCI reciben la información física como una vibración y la transforman en impulsos eléctricos que enviarán a las áreas corticales relacionadas con la audición por fibras aferentes; por el contrario, las fibras eferentes que terminan en las CCE son necesarias para facilitar el influjo modulador del SNC al que están sometidas.
La función de las CCE no terminó de aclararse hasta que se supo que estas células poseen capacidad contráctil. Se han propuesto dos mecanismos como posibles reguladores en las propiedades mecánicas de las CCE.6 Uno de ellos está relacionado con la acetilcolina (neurotransmisor de la vía eferente) cuyo estímulo reduce el tamaño del las CCE porque se contraen en el sentido de su eje mayor, mientras que el otro está propiciado por un aumento del calcio intracelular libre, lo que ocasiona una elongación de las CCE, que recuperan su longitud. Esto explica por qué los niveles bajos de calcio protegen frente al trauma sonoro al reducirse la capacidad contráctil de las CCE. Sea cual sea el mecanismo que origina la contracción-recuperación de las CCE, el efector final es una proteína (prestina) que actúa como motor de esta contracción.7
El trabajo de las CCE es fundamental como «facilitadoras» de la activación de las CCI, pero también ejercen una importante función como creadoras de un segundo filtro frecuencial.8
Este complejo sistema es funcional gracias a que las células neuroepiteliales están inmersas en líquidos de diferente composición iónica, por lo que se mantiene de este modo un potencial intracelular de reposo. Así, mientras la porción apical de las células ciliadas está en contacto con endolinfa (rica en potasio y pobre en sodio) su polo basal se relaciona con la perilinfa (rica en sodio y pobre en potasio). Como veremos al estudiar otro modo fisiopatológico de promover presbiacusia, la estructura encargada del mantenimiento de esta diferente composición iónica es la estría vascular.
El mecanismo de transducción en la cóclea está, por tanto, íntimamente ligado al flujo endolinfático de potasio. Parte de este potasio se transporta de célula a célula a través de las uniones celulares (tipo gap-junctions) existentes en las células intermediarias de la estría vascular. Las alteraciones estructurales en estas uniones celulares, como ocurre cuando algunas de las proteínas que las forman –conexinas 26, 30 y 43– están genéticamente deterioradas, dan lugar a hipoacusias neurosensoriales de intensidad variable.
En estas funciones peculiares de las células ciliadas y sobre todo en el umbral de energía mecánica capaz de estimular las CCI, puede encontrarse una explicación a la aparición del reclutamiento (recruitment). Además, tras la pérdida de células ciliadas se elevan los umbrales de excitación de las fibras del nervio coclear, lo que parece tener también implicaciones en la creación de este fenómeno. El fenómeno del reclutamiento es un dato diagnóstico de sustancial importancia que ocurre específicamente en sorderas originadas por lesiones cocleares que afectan a las CCE, que es parte de lo que ocurre en la presbiacusia.
En la presbiacusia sensorial (el tipo 1 de Schuknecht) ocurre una degeneración y posterior desaparición de células ciliadas (figura 2); esta involución comienza en la espira basal de la cóclea y desde ella va progresando hacia las rampas superiores. Esta degeneración del órgano de Corti, como decimos, es siempre más patente en las zonas basales, por ello la pérdida de audición afecta inicialmente más a las frecuencias agudas (4-8 kHz) mientras que se conservan aceptablemente las graves. La degeneración de las células neurosensoriales comienza a una edad media de la vida, afecta primero a las CCE y se continúa al evolucionar el trastorno con afectación de las CCI.
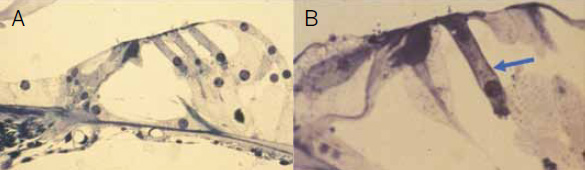
Figura 2.
A) Órgano de Corti normal. B) En este espécimen solo persiste la primera hilera de las CCE (flecha).
Esta desaparición de CCE y CCI ocurre en un contexto de involución general del órgano de Corti, hasta su completa desaparición (figura 3). En el entorno de las células ciliadas probablemente ocurrirán también alteraciones iónicas del Na, K y Ca endo y exocelulares, disturbios cuantitativos y cualitativos de los neurotransmisores, etcétera. Dentro de la difusa anatomía patológica de la presbiacusia, que como veremos afecta a distintas estructuras del sistema auditivo periférico, estas lesiones del órgano de Corti son las más típicas, constantes e importantes.
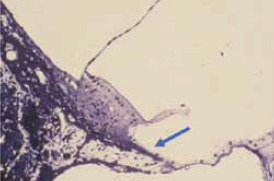
Figura 3.
La desaparición del órgano de Corti que se observa en la imagen, que puede inducirse con ruido traumatizante, se asemeja a lo que ocurre en los puntos más afectados por la presbiacusia. El órgano de Corti es sustituido por un epitelio de revestimiento (flecha).
La transducción. Creación de un potencial de acción en la fibra nerviosa. Presbiacusia neuronal
La permeabilidad de la membrana celular en las zonas apicales de las células ciliadas se modifica en relación directa con la deflexión de los cilios. Es decir, cuando se angulan los cilios al ser proyectados contra la tectoria, varía la resistencia eléctrica de la membrana celular, con lo que ocurren fenómenos de despolarización en las células ciliadas que conducen a una modificación de su potencial de reposo.
Se sabe que esto ocurre de la siguiente manera: al angularse los cilios en dirección a la estría vascular se abren canales localizados en la porción apical celular y penetra K+ al interior celular. Se produce entonces una onda de despolarización que llega a la base o polo basal de la célula (figura 4). En esta base existen unos canales para el calcio de apertura voltaje-dependiente, durante la despolarización estos canales se abren, y penetra calcio en la célula; esto hace que las vesículas presinápticas se fusionen con la membrana celular para después abrirse al exterior liberando su contenido (glutamato) en el espacio sináptico, donde se encuentra con las dendritas de las neuronas aferentes (fibra nerviosa) (figura 5). Por el contrario, el movimiento opuesto de los cilios cierra los canales impidiendo el paso de K+ a la célula, se hiperpolariza la membrana y se inhibe el sistema. En ausencia de estímulo, cuando los cilios permanecen inmóviles, hay un equilibrio activo con algunos canales para calcio abriéndose y cerrándose, con lo que continuamente hay vestigios de neurotransmisión en el espacio sináptico. Como ya hemos mencionado, el neurotransmisor entre la CCI y la primera neurona es el glutamato. Este neurotransmisor posee la característica de que puede llegar a ser neurotóxico si se libera en exceso, ya que favorece la apertura de canales de calcio en la célula postsináptica, con la consiguiente entrada al interior celular donde causa su efecto tóxico.9
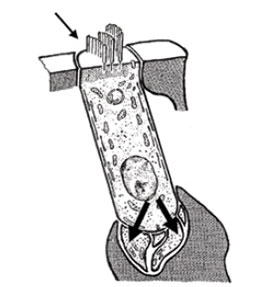
Figura 4.
Al deformarse los cilios (flecha) aumenta la permeabilidad de la membrana celular para el paso de iones, lo que induce fenómenos de despolarización en la CCI y la activación del polo basal (flecha doble).
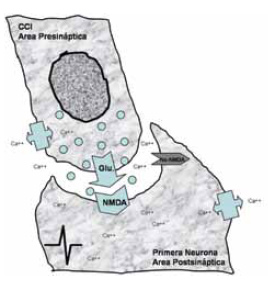
Figura 5.
El cambio eléctrico en la CCI origina la liberación de neurotransmisores en el polo basal (glutamato), que actúan sobre las sinapsis de las terminaciones nerviosas de las fibras del nervio coclear en el área postsináptica.
Como hemos visto, cuando la modificación del potencial de reposo alcanza su «umbral», en el polo sináptico de la célula se libera un neurotransmisor –glutamato– que es captado por el elemento postsináptico y va a originar un potencial de acción en la fibra nerviosa. Por este sistema, las células ciliadas han transformado la energía mecánica que actúa sobre sus cilios en energía bioeléctrica que, tras la transmisión sináptica, induce la aparición de un potencial de acción en el nervio coclear (figura 6). El término transformar no es completamente correcto porque la energía eléctrica producida en las células ciliadas no es la conversión de la energía acústica/mecánica; esta únicamente origina la liberación de la primera. Como la célula ciliada, además de transducir, actúa a modo de amplificador biológico, necesita una gran cantidad de energía; por ello, el órgano de Corti requiere un extraordinario aporte energético para efectuar su trabajo.
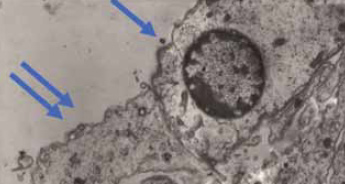
Figura 6.
La imagen muestra el área presináptica con el núcleo de una CCI (flecha) y el botón sináptico del área postsináptica en la primera neurona (flecha doble). Las neuronas bipolares del ganglio espiral de Corti (primeras neuronas de la vía auditiva) emiten una rama periférica hacia las CCI o CCE y un axón hacia la segunda neurona de la vía. Cada CCI está inervada por al menos una neurona a la que envía información aferente.
La presbiacusia neuronal (el tipo 2) se caracteriza por la degeneración y desaparición de neuronas en el ganglio espiral de Corti, y subsiguientemente en el VIII par, en el resto de la vía auditiva y en el área auditiva de la corteza cerebral. Desde Brody,10 se conoce bien que la población neuronal del SNC comienza a disminuir a edades relativamente precoces de la vida, y que continúa el detrimento hasta la muerte; esto mismo ocurre en el ganglio de Corti, las vías y los centros del aparato auditivo. Aunque la involución neuronal comienza pronto, sus manifestaciones clínicas son afortunadamente tardías, por ello, la hipoacusia que origina suele aparecer a edad avanzada. El hecho fundamental es la involución de la población neuronal en el ganglio espiral de Corti (figura 7) y la disminución de las fibras nerviosas que atraviesan la criba espiroidea de la lámina espiral ósea; estos hechos ocurren más precozmente en las zonas próximas a la espira basal de la cóclea. Se debe considerar también la pérdida de neuronas en toda la corteza cerebral, incluidas las áreas auditivas, la pérdida de audición que condiciona afecta a la comprensión de la palabra, y a aspectos intelectivos y psico-acústicos fundamentales para la interpretación de la información auditiva. Si atendemos a que existe una involución neuronal de las áreas auditivas corticales, debemos considerar la presbiacusia neuronal como una manifestación más de la demencia senil. En este tipo de presbiacusia, además de incluir la alteración de la neurotransmisión desde las células neurosensoriales a la terminación nerviosa y la disminución de población neuronal en el ganglio, debemos integrar la consecuente alteración del sistema auditivo central. No insistimos en ello por ser motivo del próximo capítulo.
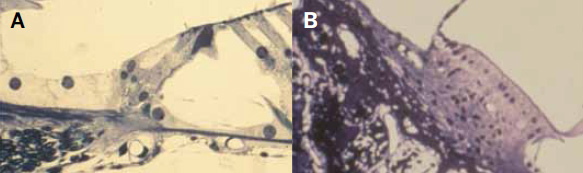
Figura 7.
A) Ganglio de Corti normal, con su gran riqueza neuronal. B) Ganglio de Corti con escasa población neuronal.
Fisiología de los líquidos laberinticos. La estría vascular. Presbiacusia estrial
Para que en el oído interno pueda generarse un potencial de acción, es preciso que exista una diferencia de potencial entre la endolinfa y la perilinfa. Es la estría vascular la que mantiene el nivel electrolítico de la endolinfa al suministrar y aclarar iones en la rampa media (conducto coclear). La perilinfa intercambia iones con la endolinfa por permeabilidad de la membrana de Reissner. Con ello se logra un nivel electrolítico de 140 mEq/l de Na y 4 mEq/l de K en la perilinfa, y de 1 mEq/l de Na y 165 mEq/l de K en la endolinfa (figura 8).
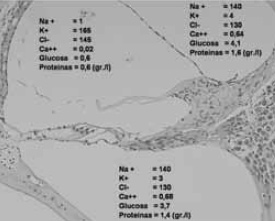
Figura 8.
Las diferentes concentraciones iónicas originan distintas cargas eléctricas: +80 mV en la endolinfa y –40 mV en las células ciliadas. Con ello se crea una diferencia de potencial de unos 120 mV. El control de las concentraciones iónicas depende de la transferencia de electrolitos entre endo y perilinfa, y de la circulación de los líquidos en el oído interno.
La perilinfa (rica en Na+) tiene un doble origen: la perilinfa coclear procede del líquido cefalorraquídeo, con el que comparte gran parte de sus características químicas y composición iónica. El líquido cefalorraquídeo alcanza la rampa timpánica a través del acueducto coclear; en cambio, la perilinfa vestibular se origina a partir de un ultrafiltrado plasmático, por lo que la concentración en K+, proteínas y glucosa es más elevada que la de la perilinfa coclear. Este doble origen explica la diferente composición de la perilinfa según se obtenga de la rampa vestibular o de la timpánica, a pesar de su comunicación por el helicotrema.
La perilinfa es parcialmente transformada en las células marginales de la estría vestibular y las células oscuras y del planum semilunatum vestibulares para formar endolinfa. En esta transformación es esencial el transporte transcelular de K+ realizado por una bomba Na+/K+ ATPasa-dependiente situada en las porciones basales de las membranas de las células citadas. La endolinfa será reabsorbida finalmente en el saco endolinfático.
De este modo, la estría vascular mantiene (como una batería eléctrica) el potencial del conducto coclear o rampa media que es de +80 mV. En cuanto a las células ciliadas, en condiciones de reposo, las CCE tienen un potencial de -70 mV y las CCI de -40 mV. Por ello, entre el potencial endolinfático positivo de la rampa media y el intracelular negativo de las células ciliadas se establece una diferencia de potencial de aproximadamente 120 mV (potenciales microfónico coclear y de sumación).
La presbiacusia estrial (el tipo 3) se desencadena por la atrofia de la estría vascular (figura 9), hecho comprobado por varios estudios histopatológicos. Esta atrofia origina una alteración iónica que causa anomalías en el potencial eléctrico del conducto coclear o rampa media. La alteración estrial se acompaña de cambios en el ligamento espiral que son consecuencia de ella.
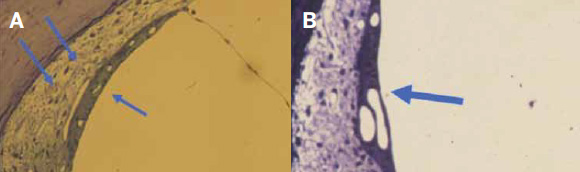
Figura 9.
La estría vascular es el único epitelio que tiene vasos. A) Estría vascular normal (flecha) y bajo ella el ligamento espiral (flecha doble). B) Estría vascular atrófica.
La involución de la estría vascular puede comenzar a edades tempranas, pero evoluciona muy lentamente, de modo que su atrofia produce un déficit auditivo en edades muy avanzadas. Aparece en grupos familiares, es más frecuente en mujeres y se caracteriza por una pérdida de audición que es igual para todas las frecuencias.
Mecánica coclear. Acontecimientos hidráulicos y mecánicos. presbiacusia de conducción coclear
Los movimientos del estribo producen una onda líquida en la perilinfa de la rampa vestibular (onda viajera). La membrana vestibular de Reissner es tan sutil y se desplaza tan fácilmente que no dificulta el paso de esta onda sonora de la rampa vestibular a la rampa media; por ello, la rampa vestibular y la rampa media o conducto coclear se consideran –desde el punto de vista de la mecánica hidráulica– como un todo, como una rampa única en cuanto a la transmisión del sonido se refiere (figura 10).
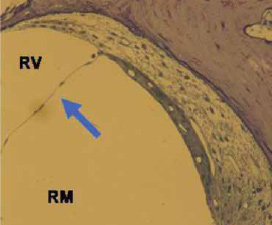
Figura 10.
La membrana vestibular de Reissner (flecha) es inapreciable desde el punto de vista hidráulico, por ello la rampa vestibular (RV) y la rampa media o conducto coclear (RM) se consideran como una rampa única en cuanto a la transmisión de la onda viajera se refiere.
La onda de líquido producida por el estribo se desplaza a lo largo del conjunto rampa vestibular-conducto coclear y pone en vibración la membrana basilar. Esta adquiere un movimiento ondulatorio que es sincrónico con la frecuencia del estímulo sonoro. La ondulación de la membrana basilar «viaja» desde la ventana oval hacia el helicotrema.
Esta «onda viajera» tiene unas características particulares. La amplitud de onda aumenta progresivamente hasta alcanzar un punto máximo o amplitud máxima. Sobrepasado este, la amplitud de la onda disminuye muy rápidamente hasta alcanzar una amplitud 0, cuando desaparece el movimiento ondulatorio.
Así, cualquier estímulo sonoro ocasiona un movimiento ondulatorio de la membrana basilar. El punto de máximo desplazamiento de la onda, la amplitud máxima, se localiza en distintos lugares de la cóclea, en función de la frecuencia del sonido que la ha creado. En los sonidos agudos (de alta frecuencia), el movimiento ondulatorio se agota enseguida, y el máximo desplazamiento ocurre en un punto próximo a la ventana oval; en los sonidos graves (de baja frecuencia) la onda viaja más y su amplitud máxima se sitúa en un punto próximo al ápex, cerca del helicotrema.
Las características de la onda viajera están notablemente influenciadas por una serie de peculiaridades de la membrana basilar: físicas (longitud, grosor, masa, rigidez…) (figura 11), histológicas y funcionales (figura 12). En la presbiacusia, el grosor, la masa y, sobre todo, la rigidez de esta membrana se modifican, con lo que disminuye su capacidad de movimiento al paso de la onda viajera.
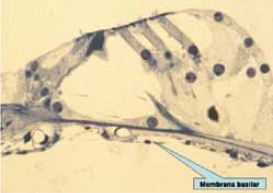
Figura 11.
El mantenimiento a través del tiempo de la longitud, grosor, masa y rigidez de la membrana basilar es fundamental para una eficaz mecánica coclear.
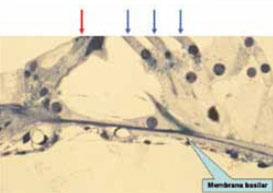
Figura 12.
La membrana basilar tiene mayor capacidad de movimiento bajo las CCE (flechas azules) que bajo las CCI (flecha roja).
No está claro porqué ocurre pérdida precoz de frecuencias agudas en la presbiacusia, probablemente varios factores intervienen en el origen del evento; uno de ellos es la alteración de la conducción coclear por aumento de la rigidez de la membrana basilar. Hasta el momento presente, se acepta que solo el punto de amplitud máxima de la onda viajera estimula el órgano de Corti, aunque la onda origina distintos picos de amplitud cuya significación desconocemos. Recordamos que la máxima amplitud para los agudos se localiza en la zona basal de la cóclea y, para los graves, en la zona del ápex; asimismo, esta máxima amplitud se localiza en puntos intermedios para las distintas frecuencias sucesivas. Por este mecanismo se discriminan en la cóclea los diversos tonos del sonido. Es probable que el aumento de rigidez del sistema sea más patente en rampas de la base de la cóclea.
Las estructuras huecas del oído interno están completamente repletas de líquido, y al ser los líquidos incompresibles, para que la platina del estribo pueda introducirse cómodamente en el laberinto se necesita una zona elástica que se desplace en sentido opuesto al movimiento de la platina (oposición de fase). Esta función la cubre la ventana redonda, obturada por su membrana elástica o falso tímpano. Por ello, a un movimiento del estribo hacia dentro (hacia el oído interno) corresponde un abombamiento de la membrana de la ventana redonda hacia fuera (hacia el oído medio) y viceversa, el llamado juego de ventanas. Para que este juego ocurra debe permanecer perfectamente activa la movilidad del estribo y la elasticidad del falso tímpano. En este punto podría verse afectada la actitud hidráulica de la onda viajera; en la presbiacusia existen cambios en la elasticidad de las membranas y en la movilidad de la cadena, como veremos más adelante. Por lo expuesto en este esquema de la mecánica e hidráulica coclear vemos que la membrana basilar hace de «filtro», y se comporta como un analizador mecánico de frecuencias: distribuye la onda sonora según su frecuencia por distintos lugares de la cóclea. Se cree que la onda, aunque es activa solo en el lugar de máxima amplitud, estimula todavía un espacio excesivo del órgano de Corti, por lo que no puede realizarse una exquisita discriminación de frecuencias; en este primer filtro se efectúa solo una diferenciación elemental inicial. Hace falta un «segundo filtro frecuencial» para obtener la perfecta percepción individualizada de las frecuencias; este segundo filtro se halla ligado a la capacidad contráctil de las células CCE, cuyos cilios se anclan en la membrana tectoria, traccionan de ella cuando se contraen y aproximan de este modo la tectoria a las células ciliadas internas, de modo que facilitan la descarga de un potencial de acción.
La presbiacusia de conducción coclear (el tipo 4) ocurre por la suma de varios fenómenos, pero singularmente por disminución de la elasticidad de la membrana basilar. Con el transcurso del tiempo, acontecen acúmulos de calcio, hialinización, depósitos de lípidos y, en general, fenómenos que abocan a un engrosamiento y endurecimiento de la membrana basilar. Esta membrana, al ser más rígida, aumenta su impedancia y transmite con mayor dificultad la onda viajera al órgano de Corti.
En su tipificación, Schuknecht5 describe también cambios en el ligamento espiral relacionados con la edad, fundamentalmente disminución de la concentración de fibrocitos en la porción del ligamento próxima a la membrana basilar.
Otras alteraciones del sistema auditivo periférico que influyen en la fisiopatología de la presbiacusia
Además de las lesiones descritas, ya clásicas y sistematizadas inicialmente por Schuknecht5, que son las responsables de la hipoacusia neurosensorial, en el oído medio también ocurren cambios degenerativos típicos del envejecimiento.
En las personas mayores, en toda la periferia de la membrana timpánica se sedimenta un depósito cálcico que, a modo de círculo blanco, bordea todo el contorno, y se conoce como arco senil. Este y otros fenómenos de miringosclerosis disminuyen la elasticidad de la membrana timpánica y su actividad funcional. La miringosclerosis y la timpanosclerosis –cuando existen– se hacen más patentes en la ancianidad; las placas de timpanosclerosis atrapan la cadena de osículos y, principalmente, el estribo, y dificultan su desplazamiento.
Como en todo el sistema osteo-articular de la economía, la ancianidad ocasiona que en los osículos de la cadena (figura 13) aparezca osteoporosis, y que en las articulaciones ocurran alteraciones degenerativas en las superficies articulares típicas de la artrosis11, 12 (figura 14). Estos cambios que ocurren en la involución osteo-articular limitan la movilidad del conjunto de los sistemas de transmisión mecánica de la energía sonora, sistemas cuya concepción funcional ha sufrido cambios significativos tras las recientes aplicaciones computadorizadas de investigación (figura 15) y con la aplicación en estos estudios del método de los elementos finitos (figura16).13, 14, 15 A estos cambios producidos por fenómenos artrósicos y de desmineralización se suman alteraciones del tono, que disminuyen la eficacia de la contracción de los músculos del oído medio.16

Figura 13.
El sistema mecánico del oído medio está sometido a los mismos cambios involutivos que otros sistemas osteoarticulares del organismo: osteoporosis, artrosis, rigidez de membranas…
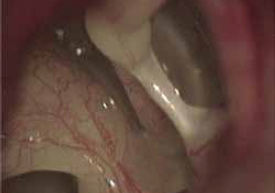
Figura 14.
En la presbiacusia, la involución más invocada es la desaparición de células ciliadas, pero la disminución de la elasticidad de la membrana timpánica, del ligamento anular de Rüdinger, del falso tímpano y las disfunciones del reflejo del estribo deben ser tenidos en cuenta.
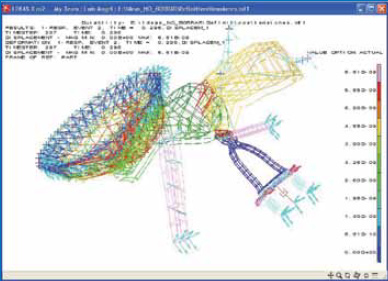
Figura 15.
Cálculo computadorizado de la fisiología de la transmisión en el oído medio.
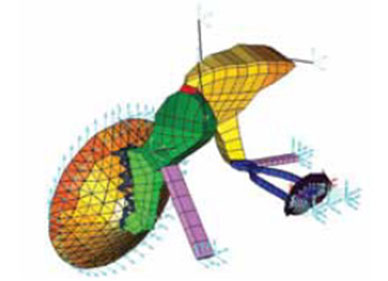
Figura 16.
Modelo 3D final del oído medio. En los modelos computadorizados 3D realizados por el método de los elementos finitos, se pueden introducir modificaciones que simulen los acontecimientos que ocurren en el oído medio en la presbiacusia.
En la membrana timpánica, además de los posibles depósitos minerales, ocurren alteraciones vasculares con disminución del aporte sanguíneo y una pérdida de elasticidad por rigidez de la capa conectiva media de la membrana.17
Se han descrito otros cambios debidos a la involución por la edad. Los publicados por Krmpotic- Nemanic et al.18 se refieren a una hiperosteosis en la criba espiroidea de la cóclea. Según estos autores, la osificación del cuadrante coclear del fondo del conducto auditivo interno comprime y destruye las fibras cocleares a su paso por los pequeños orificios de la criba.
Otros autores han encontrado deleciones en el ADN mitocondrial que aparecen con la edad, y que probablemente pueden estar en relación con el desarrollo de presbiacusia.19
En conclusión, parece claro que la disminución de células neurosensoriales, que comienza precozmente con la desaparición de CCE20 y continúa cuando avanza la involución con la desaparición de todo el órgano de Corti, que es sustituido por un epitelio de revestimiento,21 es el fenómeno fisiopatológico fundamental en la creación de hipoacusia en el anciano. Pero terminamos el capítulo insistiendo en que no se deben considerar independientemente los distintos mecanismos fisiopatológicos que originan la presbiacusia. Varias de las alteraciones descritas en el sistema auditivo periférico se suman y producen de manera multifactorial la sordera que afecta al anciano. Además, otros muchos disturbios más o menos independientes de los descritos aquí pueden influir, como veremos en el próximo capítulo, que relata lo que ocurre con el paso del tiempo en el sistema auditivo central.
Bibliografía
- Rivera, T. «Presbiacusia». En: Tratado de otorrinolaringología y cirugía de cabeza y cuello. Suárez, c.; Gil-Carcedo, L.M.; Marco, J.; Medina, J.E.; Ortega, P.; Trinidad, J. Tomo II, 2.ª edición. Madrid: Edit. Med. Panamericana, 2007. Págs. 1625-34.
- Gil-Carcedo, L.M. Otología. Barcelona: Ed. Vila Sala Hnos, 1997. Págs. 465-71.
- Gil-Carcedo, L.M.; Vallejo, l.A., Gil-Carcedo, E. Otología. 2.ª edición. Madrid: Ed. Med. Panamericana, 2004. Págs. 305-10.
- Gil-Carcedo, L.M.; Vallejo, L.A., Gil-Carcedo, E. Otología. 3.ª edición. Madrid: Ed. Med. Panamericana, 2011. Págs. 333-8.
- Schuknecht, H.F. Pathology of the Ear. Cambridge, Mass. (USA): Harvard University Press, 1974. Págs. 388-91.
- Gulick, W.L.; Gescheider, G.A.; Frisina, R.D. «Transduction and cochlear mechanism». En: Hearing: Physiological Acoustic, Neural Coding, and Psychoacoustics. Oxford: Ed. Oxford University Press, 1989.
- Frolenkov, G.I.; Mammano, F.; Kachar, B. «Regulation of outer hair cell cytoskeletal stiffness by intracelullar calcio: underlying mechanism and implications for cochlear mechanics». Cell Calcium, 2003. Págs. 33:185-95.
- Geleoc, G.S., Holt, J.R. «Auditory amplification: outer hair cell press the issue». Trends Neurosci, 2003. Págs. 26:115-7.
- Wangemann, P. «K+ cicling and the endocochlear potential». Hear Res., 2002. Págs. 165:1-9.
- Brody, H. «Structural changes in the aging nervous system». En: Bluementhal, H. T. The regulatory role of the nervous system in aging. Interdisciplinary topics in Gerontology, Vol. 7. Munich: Karger, 1970. Págs. 9-21.
- Michaels. L. «Presbycusis». En: Alberti, P.W.; Ruben, R.J. Otologic Medicine and Surgery. N. Y. (USA): Ed. Churchill Livingstone, 1988 Págs. 676-82.
- Belal, A.; Stewart, T. «Pathological changes in the middle ear joints». Ann. Otol. Rhinol. Laryngol, 1974. Págs. 83:159-65.
- Gil-Carcedo, E.; Pérez, B.; Vallejo, l.A.; Gil-Carcedo, L.M.; Montoya, F. «Modelo computadorizado 3D para el estudio de la biomecánica del oído medio con el método de los elementos finitos (MEF)». Acta Otorrinolaringol. Esp., 2002. Págs. 53:407-10.
- Wada, H.; Metoki, T. «Analysis of a dynamic behaviour of human middle ear using a finite element method». J. Acoust. Soc. Am., 1992. Págs. 96:3157-68.
- Vallejo, L.A.; Hidalgo, A.; Lobo, F.; Tesorero, M.A.; Gil-Carcedo, E.; Sánchez, e.; Gil-Carcedo, L.M. «¿Es el oído medio el primer filtro de selección frecuencial?» Acta Otorrinolaringol. Esp., 2010. Págs. 61:118 -27.
- Etholm, B.; Belal, A. «Senile changes en middle ear joints». Ann. Otol. Rhinol. Laryngol., 1974. Págs. 83:49-54.
- Ruah, C.B.; Scaachen, P. A.; Zelterman, D. «Age-related morphologic changes in the human tympanic membrana: a light and electron microscopic study.» Arch. Otolaryngol. Head Neck Surg., 1991. Págs. 117:627-34.
- Krmpotic-nemanic, J.; Nemanic, D.; Kostovic, I. «Macroscopical and microscopical changes in the bottom of the internal auditory meatus». Stockholm: Acta Otolaryngol., 1972. Págs. 73:254-58.
- Bai, U.; Seidman, M. D.; Hinojosa, R.; Quirk, W.S. «Mitochondrial DNA delections associated with aging and possibly prebycusis. A human temporal bone study». Am. J. Otol., 1997. Págs. 18:449-53.
- Gratton, M.A.; Vázquez, A.F. «Age-related hearing loss: current research». Curr. Opin. Otolaryngol. Head Neck Surg., 2003. Págs. 11:367-71.
- Bouccara, D.; Ferrary, E.; Mosnier, I.; Bozorg, A.; Stekers, O. «Presbyacousie». Encyclopedie Medico Chirurgicale. «Otorhinolaryngologie». Paris: Elsevier SAS. Págs. 2005:1-10.
Todas las imágenes que aparecen en este capítulo se han realizado en la Cátedra de ORL de la UVa para distintos trabajos de investigación. Se han utilizado cobayas del animalario de la UVa.
Los autores, de acuerdo con el Real Decreto 1201/2005 sobre protección de los animales utilizados para experimentación, poseen la Homologación como personal competente para trabajar con dichos animales (N.° de registro del centro usuario AE 4718614 AB).

