Prof. Pablo Gil-Loyzaga - Profª Bárbara Romero Gómez - Prof. Francisco Carricondo Orejana
Presbiacusia: envejecimiento de la vía auditiva central
Laboratorio de Neurobiología de la Audición (Grupo UCM 910915), Dpto. de Inmunología, Oftalmología y Otorrinolaringología, Facultad de Medicina, IdISSC, Universidad Complutense de Madrid
Introducción
La posibilidad de envejecer es, en sí misma, un auténtico triunfo, sobre todo si se cuenta con una buena calidad de vida y escaso deterioro sensorial (visual y auditivo, especialmente). A este respecto, el filósofo Frank Notestein (1954) afirmaba que: «Analizado en conjunto, el envejecimiento no es un problema en absoluto, es solo la forma pesimista con que se analiza un gran triunfo de la civilización».
Como dato relevante cabe destacar que en 1998 había en el mundo 66 millones de octogenarios, y alcanzarán los 370 millones en el entorno del año 2050 (Álvarez Perelló, 2001). La española, como las demás sociedades occidentales, está experimentando un proceso de incremento de la expectativa de vida, incluso de la calidad de vida en los mayores, y de su esperanza de vida libre de discapacidad (Gil- Loyzaga y Gil Pérez, 2009). Datos recientes indican que en España los nacidos en 2009 tendrán una esperanza de vida de 50 años más que si hubieran nacido en 1870; que será el doble de la que hubieran tenido en 1910 (entonces era de 40 años). Los mayores de sesenta y cinco o setenta años desean gozar de un buen nivel de salud y actividad; constituyen un segmento social importante y creciente que ha sido bautizado como la sociedad longevital (Gaullier, 2003). El mantenimiento de la actividad funcional del sistema nervioso central juega un papel muy relevante para evitar el envejecimiento global del individuo, de su relación con el entorno, de su integración social, etcétera.
Envejecimiento del sistema nervioso central
El proceso de envejecimiento afecta a todos los organismos pluricelulares mediante mecanismos de degeneración celular progresiva e irreversible, por procesos de desgaste y por la progresiva reducción de la actividad física e intelectual, y concluye en la muerte celular (Jazwinski, 1998; Nagley y Wei, 1998). Aunque se trata de un proceso panorgánico, no afecta por igual a todos los órganos o sistemas, dado su diferente metabolismo o su muy distinta capacidad de regeneración. En el envejecimiento intervienen numerosos factores genéticos y familiares pero, sobre todo, factores epigenéticos, fisiológicos o patológicos, que actúan a lo largo de la vida y que llevan a que existan importantes diferencias poblacionales tanto en la longevidad como enla calidad de vida de los ancianos (Jazwinski, 1998; Álvarez Perelló, 2001).
Uno de los sistemas más afectados por el envejecimiento es el sistema nervioso central ya que las neuronas carecen de una capacidad de regeneración que tenga realmente relevancia funcional. Las alteraciones derivadas del envejecimiento en el sistema nervioso central son especialmente complejas. No solo comportan la muerte neuronal, sino también la desorganización y reorganización de circuitos neurales, incluidos los contactos sinápticos, y diversas modificaciones de los neurotransmisores de los sistemas activadores y de los moduladores e inhibidores (Mora y cols., 2010). La plasticidad neural permite el mantenimiento, incremento y recuperación de los circuitos neurales (Gil- Loyzaga, 2007, 2009, 2011; Gil-Loyzaga y cols., 2009, 2010). También durante el envejecimiento el sistema nervioso solo cuenta con mecanismos de plasticidad neural para mantener una actividad funcional adecuada y compensar las inevitables pérdidas neuronales. El progresivo deterioro senil que se manifiesta a nivel neural es, sin duda, el aspecto que más influye en el límite de la vida de un individuo.
En el ser humano, el envejecimiento del sistema nervioso no solo afecta a aspectos primarios del individuo, como la recepción de información o la motilidad, sino sobre todo a los procesos intelectuales y de comportamiento. Es bien conocido que en los ancianos la pérdida auditiva asociada a su edad combina efectos centrales y periféricos; para el sistema auditivo esta combinación supone dificultades de procesamiento del sonido y, en especial, del lenguaje (Caspary y cols., 2008). Pero este tipo de hipoacusia puede no encontrarse aislada, sino asociada con alteraciones psicológicas, como aislamiento, depresión, e incluso demencia, etc. (Gates, 2005), socio-laborales (Resnick y cols., 1997) y también un deterioro intelectual, más o menos acusado, del comportamiento, de la personalidad, etc. (Zarit y Knight, 1996). Las alteraciones centrales afectan sobre todo a la memoria, al procesamiento de la información y la toma de decisiones, la reducción significativa de las destrezas y habilidades y de la velocidad de ejecución de los mismos, y a una muy notable alteración de los sistemas sensoriales. Esta regresión de los sistemas sensoriales afecta, en mayor o menor medida, a más de la mitad de los individuos mayores de 65 años y en un alto porcentaje se acompaña o está agravada por el desarrollo de patologías psiquiátricas o neurológicas (por ejemplo, Parkinson, Alzheimer, etc.) (Katzman, 1988; Selkoe, 1991).
Presbiacusia periférica y presbiacusia central
Se define la presbiacusia como la pérdida progresiva, bilateral y, casi siempre, simétrica de la audición, que se relaciona con el envejecimiento del individuo, es decir, con el de su sistema auditivo (Schuknecht y Gacek, 1993). Quedan, por lo tanto, excluidas las hipoacusias que tengan un origen traumático del cráneo, genético (síndromes de sordera congénita, por ejemplo), o patologías que afecten de manera específica al receptor auditivo (trauma acústico, ototoxicidad, patologías cocleovestibulares, etc.) (Ciges y cols., 1999; Martín del Campo y cols., 2012; Willott y cols., 2001), o patologías generales como las metabólicas (hipotiroidismo, diabetes, hipertensión) o las patologías vasculares (arteriosclerosis, trombosis) e hipóxico-isquémicas (más frecuentes en los ancianos). En cuanto a estas últimas, diversos trabajos experimentales han mostrado que la hipoxia coclear favorece la generación del estrés oxidativo, con los consiguientes daños en las mitocondrias (Seidman, 2000).
Sin embargo, esto no excluye que en la fisiopatología y en la evolución de la presbiacusia, además de la edad haya que tener en cuenta, en primer lugar, aspectos genético-hereditarios (antecedentes familiares de hipoacusia), que hagan más susceptible al receptor auditivo al envejecimiento (Gates y Myers, 1999). Y también el sexo representa una diferencia notable en tanto que este tipo de alteración es más frecuente en varones, mayores de 60 años, que en mujeres (Ciges y cols., 1999; Patterson y cols., 1981). Es muy probable que diferencias en el ADN, o secuencias genéticas heredables, tengan que ver con una cierta predisposición que favorezca, o no, el envejecimiento auditivo (Ensink y cols., 1998). Es muy evidente que el componente genético ayuda a entender las muy amplias diferencias de afectación auditiva que se observan en los ancianos (Weinstein, 2000). También la exposición al ruido continuado a lo largo de la vida, u otros factores (ototóxicos, etc.), pueden ser aspectos coadyuvantes que favorezcan el envejecimiento auditivo (Howarth y Shone, 2006).
Al combinar estos hechos con lo conocido a partir de los datos clínicos y experimentales es fácil entender cómo, en el momento actual, se ha decidido definir la presbiacusia como un proceso multifactorial que, además, afecta de manera diferente a los distintos pacientes (Gates, 2005). De hecho, actualmente se considera esta afectación auditiva como secundaria al deterioro senil global del individuo, sobre el que se superponen las principales alteraciones padecidas a lo largo de la vida (estrés auditivo, ruido, hipoxias, etc.) que, con el perfil genético individual, permiten justificar las diferencias observadas entre individuos (Gates, 2009).
Los síntomas más precoces de presbiacusia pueden presentarse, solo en algún individuo, a la mitad de la cuarta década de vida; aunque la mayoría de los pacientes no tienen deterioro significativo hasta los 60 a 65 años. La pérdida auditiva aumenta con la edad de forma progresiva, y se pierden unos 9 dB/década a partir de los 55-60 años (Jennings y Jones, 2001). A partir de los 65, más del 35% de los adultos están afectados por presbiacusia, más o menos intensa, y alcanzan el 45% a partir de los 75 años (Gates y Mills, 2005; Proupín y cols., 2007). En Inglaterra, la situación parece aún peor cuando en 1998 se indicaba que el 53% de los hombres y el 41% de las mujeres mayores de 75 años tenían alguna alteración auditiva (Howarth y Shone, 2006).
Hace más de seis décadas el Prof. Harold F. Schuknecht (Schuknecht, 1955) describió los efectos de envejecimiento del receptor auditivo aportando, en aquella y en otras publicaciones posteriores, una clasificación etiológica basada especialmente en las alteraciones auditivas periféricas vinculadas al envejecimiento. Así, desde aquellos estudios se diferencia la presbiacusia de origen sensorial (que afecta inicialmente a las células receptoras o ciliadas), neural (de mayor incidencia sobre las neuronas ganglionares y fibras del nervio auditivo), metabólica o estrial (con afectación básica en la producción de endolinfa por la estría vascular), conductiva (por alteraciones diversas de la membrana basilar que algunos autores discuten), y mixta (que tiene características de varias de las anteriores, en especial de las dos primeras (Ciges y cols., 1999; Rivera, 2007; Gates, 2009). En este sentido, parece evidente que muchas de las alteraciones auditivas del anciano pueden tener un origen en el receptor periférico, aunque no cabe duda de que los efectos más importantes son los que implican a la vía auditiva (del receptor hacia la corteza). Esto resulta evidente al comprobar que el procesamiento del mensaje auditivo, sobre todo en lo que se refiere a sonidos complejos (lenguaje, por ejemplo), afecta a un número importante de ancianos, sobre todo cuando se encuentran en ambientes ruidosos.
El hecho de que los individuos mayores (sobre todo a partir de los 60 años), incluso los que tienen una alteración auditiva periférica discreta, presenten en mayor o menor medida una capacidad reducida para la comprensión del lenguaje, especialmente en ambientes ruidosos, parece indicar la existencia concomitante de un componente de afectación en el procesamiento central (Weinstein, 2000). No cabe duda de que la afectación del sistema auditivo periférico provoca problemas de recepción y transmisión del mensaje, pero está claro que la alteración de la vía auditiva central (sobre todo de la corteza auditiva) conlleva el deterioro del procesamiento complejo y la comprensión de dicho mensaje. El procesamiento del lenguaje humano, el habla, requiere mucho más que la simple percepción de los sonidos. El mantenimiento correcto de la actividad lingüística requiere la funcionalidad combinada de numerosos circuitos de asociación, ubicados en el sistema nervioso central, entre los que destacan la memoria de corto y largo plazo, los sistemas de alerta y atención, el filtrado de información, los sistemas de toma de decisiones, etc. (Gates, 2012). Resulta relevante comentar aquí que se ha evidenciado que al menos el 70% de los mayores de 60 años presentan algún déficit auditivo que no puede ser explicado por la alteración en la percepción tonal periférica (Weinstein, 2000). Esto es lo que se ha definido como presbiacusia central.
Los estudios clínicos más recientes se vuelven a plantear la existencia de la presbiacusia central como entidad nosológica única e individualizada. Algunos investigadores afirman que, al menos en la actualidad, no existe información suficiente que confirme la existencia de la presbiacusia central como una patología independiente (Humes y cols., 2012). Se propone que, en realidad, la presbiacusia central es una alteración de etiología multifactorial (Humes y cols., 2012) en la que, obviamente, la edad y las alteraciones del sistema nervioso central (incluso otras enfermedades degenerativas) juegan papeles muy relevantes pero que no se puede separar de las alteraciones del sistema auditivo.
Efectos centrales de la presbiacusia neural periférica
Como indica Gates (2009), la división entre presbiacusia central y periférica es útil a efectos didácticos pero, en realidad, los problemas de alteración auditiva (por ejemplo, la comprensión del lenguaje) implican a todos los niveles de la vía, y por ello las alteraciones auditivas periféricas deben ser consideradas como un posible origen de alteraciones centrales. Se puede hablar de una presbiacusia periférica que afectaría sobre todo a la cóclea, al nervio auditivo y su proyección a los núcleos cocleares y una presbiacusia central, desde el tronco cerebral a la corteza (Ciges y cols., 1999). En este sentido, la denominada presbiacusia neural puede tener efectos directos claros y evidentes en el procesamiento auditivo central. Sin embargo, aunque en ambos casos de presbiacusia con afectación neural marcada, central o periférica, la inteligibilidad está reducida, se pueden establecer algunas diferencias entre ambas. Tal vez la más clara y relevante sea que cuando la alteración de la percepción del lenguaje se detecta en silencio, la lesión debe ser fundamentalmente periférica (en el binomio células receptoras-neuronas ganglionares), mientras que si en silencio la percepción del lenguaje es razonablemente buena pero se dificulta mucho en entorno ruidoso es que la alteración auditiva tiene un marcado componente central (Gates, 2009).
El efecto clínico fundamental es la denominada regresión fonémica, que se define como una menor capacidad de discriminación del lenguaje hablado que lo que correspondería a la pérdida sensorial, representada en la audiometría tonal. La regresión fonémica se justifica por la pérdida de neuronas ganglionares, pero se responsabiliza también a la afectación de la vía auditiva, derivada o primaria. Los principales problemas derivados de la pérdida neuronal, base de la regresión fonémica, serían el grave deterioro de la transmisión del mensaje neural, memoria y procesamiento central (Weinstein, 2002; Gates, 2009). Para completar la problemática de la transmisión neural en la presbiacusia no se deben obviar las posibles alteraciones gliales y de las vainas mielínicas del nervio auditivo y de los fascículos de la vía auditiva hasta la corteza.
Como ya se ha indicado, la presbiacusia neural (periférica) puede provocar alteraciones ascendentes importantes en la capacidad de procesamiento del mensaje auditivo, sobre todo cuando se trata de sonidos complejos (Arnesen, 1982; Pichora-Fuller y Souza, 2003). La presbiacusia neural, la más frecuente en humanos (Suga y Lindsay, 1976), afecta especialmente al ganglio espiral o de Corti y a sus fibras nerviosas, que constituyen el nervio auditivo. Generalmente, se considera vinculada y secundaria al envejecimiento sensorial (Schucknecht y Gacek, 1993), aunque no se puede descartar que pueda ser también primaria. Los habituales procesos de plasticidad neural permiten que la afectación percibida por el individuo no sea muy importante hasta que se haya producido, al menos, la pérdida de un 50% del total de las neuronas del ganglio de Corti.
La reducción del número de neuronas (figura 1 y 2) es un fenómeno claramente vinculado al envejecimiento, como también lo son otras alteraciones orgánicas. Hasta el punto de que la degeneración neuronal del ganglio auditivo, que afecta a todos los individuos en mayor o menor medida, podría ser de más de 2.000 neuronas por década (Arnesen, 1982; 1985). La muerte celular afecta a un notable número de neuronas ganglionares, que se inicia por una progresiva reducción de tamaño, y que conlleva pérdidas de células de los núcleos cocleares (figura 2) (Arnesen, 1982; Chisolm y cols., 2003). Las lesiones neuronales del ganglio auditivo no son homogéneas y afectan más a las neuronas de la base coclear (figura 1 y 2), lo que justifica la mayor pérdida de percepción de las frecuencias agudas (Castillo y cols., 2006). A medida que avanza el proceso, degeneran también las neuronas de la espiral media (frecuencias medias) y luego del ápex (frecuencias graves).
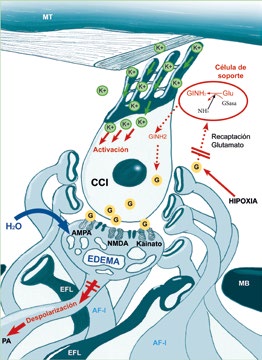
Figura 1. Neurotoxicidad glutamatérgica en la fibra aferente de tipo I del ganglio espiral.
La estimulación de la CCI hace que ésta libere neurotransmisor glutamato (G) al espacio sináptico que comparte con las fibras aferentes de tipo I del ganglio espiral (AF-I). En condiciones normales el G se une a los receptores glutamatérgicos postsinápticos (AMPA, Kainato, NMDA y otros) de la AF-I (azul claro) activándolos y produciendo el potencial de acción (PA) que dará lugar a la transmisión del mensaje auditivo al Sistema Nervioso. En condiciones patológicas, como el trauma acústico o la hipoxia/isquemia coclear, el G se libera a la hendidura sináptica masivamente mientras que los mecanismos de recaptación del G de la sinapsis se ven comprometidos, dejando de ser eficaces, y haciendo que la concentración de G aumente en la hendidura sináptica. Este incremento de G va a provocar la sobreactivación de los receptores glutamatérgicos de la AF-I permitiendo la entrada masiva de iones y de agua que darán lugar a los característicos edemas dendríticos y que pueden llegar a romper la membrana celular y provocar la muerte de la fibra nerviosa (EFL: Fibra eferente del sistema olivococlear lateral; MB: Membrana Basilar; MT: Membrana Tectoria)
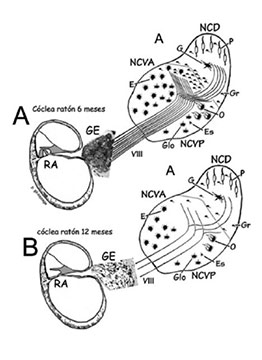
Figura 2.
Efectos de la presbiacusia en los núcleos cocleares en un modelo animal experimental (ratón C57/BL/6j). A: Espira basal coclear (izquierda) de un ratón adulto joven (6 meses de edad). El receptor auditivo (RA) está indemne y el ganglio espiral (GE) está ocupado por neuronas en su totalidad. El nervio auditivo (VIII par), con abundantes fibras, penetra en los núcleos cocleares (derecha) para dividirse formando V tonotópicas en su profundidad (codificación de tonos agudos). B: Espira basal coclear (izquierda) de un ratón al inicio de la senectud (12 meses de edad). El receptor auditivo (RA) ha degenerado y el ganglio espiral (GE) solo tiene algunas neuronas. El nervio auditivo (VIII par) tiene muy pocas fibras que penetren en los núcleos cocleares (derecha) hasta la profundidad (tonos agudos). Se aprecia una fuerte reducción de las neuronas de los núcleos cocleares, en concreto de la zona de proyección de las fibras afectadas.
La reducción del número de neuronas ganglionares es progresiva, y se ha identificado en modelos experimentales (figura 1 y 2) (Gil- Loyzaga, 2002; Castillo y cols., 2006) y en humanos; no obstante, el proceso fisiopatológico a nivel celular que lleva a este deterioro neuronal no ha sido aclarado. Se ha propuesto que en estos mecanismos podrían estar implicadas las hormonas esteroideas y el IGF-1, pero también la lesión progresiva de los sistemas metabólicos, especialmente de las mitocondrias (Bao y Ohlemiller, 2010), la acumulación de radicales libres (Luxon, 1981) y la neurotoxicidad (Pujol y Puel, 1999). También se ha implicado en este proceso, y en los mecanismos de supervivencia de las neuronas, el calcio, los glucocorticoides y ciertas proteínas como las ubiquitinas (Bao y Ohlemiller, 2010). Otra de las cuestiones que aún está sin resolver es saber si este tipo de degeneración neuronal se debe a un proceso de muerte neuronal programada (apoptosis) u otro tipo de lesión celular (Bao y Ohlemiller, 2010).
El principal problema de la degeneración de las neuronas del ganglio espiral coclear es la consecuente reducción de las fibras aferentes de tipo I (figura 1 y 2). Estas fibras se originan en dichas neuronas ganglionares y alcanzan los núcleos cocleares, que son los únicos elementos que transmiten el mensaje auditivo desde el receptor a la vía auditiva (Gil-Loyzaga, 2005; Gil-Loyzaga y Poch Broto, 2007; Gil-Loyzaga y Pujol, 2010). Así, la información sonora que llega al receptor pasa a los núcleos del tronco, y alcanza luego la corteza cerebral, donde se analizan sus características acústicas (frecuencia, intensidad, fase, etc.) pero, sobre todo en los humanos, se realiza un profundo análisis de los sonidos complejos (por ejemplo, del lenguaje), lo que permite su comprensión, interacción polimodal y almacenamiento en la memoria (Pocock y Richards, 1999).
Los estudios de presbiacusia se basan en la investigación clínica de pacientes afectados y, sobre todo, en modelos animales que permitan un análisis fisiopatológico y experimental más profundo de estas alteraciones, pero estos datos experimentales deben ser bien escogidos para que los resultados sean extrapolables al ser humano (Masoro, 1990; Gil-Loyzaga, 2002). Desde un punto de vista fisiopatológico, las alteraciones centrales seniles podrían ser consecuencia de una hipoactividad del receptor auditivo periférico que, progresivamente, provoque la degeneración de cadenas de neuronas (figura 1). No obstante, no se descarta la existencia de procesos primarios de envejecimiento en el sistema nervioso central, que podrían ser derivados o concomitantes, y también vinculados al envejecimiento del individuo (Martín del Campo y cols., 2012). En cualquier caso, parece tratarse de un círculo lesional en el que no se puede descartar que, al menos, parte de las lesiones de las neuronas del ganglio auditivo se deriven de profundas alteraciones que se han observado en los sistemas de modulación y protección, como el sistema eferente olivococlear (Bartolomé y cols., 2009). Estas alteraciones podrían ser de significación funcional similar a lo observado en las neuronas GABAérgicas de la corteza auditiva durante el envejecimiento (Martín del Campo y cols., 2012). Las neuronas GABAérgicas de la corteza auditiva están implicadas en la modulación del procesamiento temporal rápido de la información auditiva (Atencio y Schreiner, 2008), muy importante en el análisis del lenguaje en los humanos. También, las neuronas olivares que constituyen el sistema olivococlear eferente tienen un claro papel modulador y de probable protección de las neuronas primarias; por tanto, sus alteraciones, o simplemente su hipofunción, podría ser responsable de la degeneración de las neuronas cocleares (Pujol y Puel, 1999). De esta forma, las lesiones presbiacúsicas periféricas podrían derivar, en alguna medida, del envejecimiento del sistema nervioso central.
Presbiacusia central
La presbiacusia central se define como la discapacidad auditiva que no se relaciona con una lesión del nervio auditivo, sino que afecta, especialmente, a la función de los centros de la vía auditiva y sus conexiones y a la corteza cerebral auditiva (Welsh y cols., 1985; Stach y cols., 1990). Se trata de una discapacidad auditiva que afecta al sistema receptor, pero también a la percepción, es decir, al procesamiento complejo de la señal auditiva. Las diferencias entre la presbiacusia periférica y la central se ponen de relieve en la sintomatología y la exploración, de forma que la presbiacusia central es aquella en la que las dificultades de comprensión del lenguaje se manifiestan sobre todo en ambiente ruidoso, aunque en silencio la percepción del lenguaje sea claramente mejor, o incluso casi normal (Gates, 2009). Y también en el ámbito terapéutico, ya que la utilización de audífonos tiene un mejor resultado en la presbiacusia periférica que en la central (Welsh y cols., 1985). No obstante, la presbiacusia central se superpone a las alteraciones periféricas, dada la complejidad de la vía auditiva y la intrincada participación en el procesamiento del lenguaje de cada nivel de la misma.
El resultado de las alteraciones concomitantes del sistema nervioso central y periférico es que un buen número de personas mayores tienen serias dificultades para la comprensión del lenguaje (Pichora-Fuller y Souza, 2003). Las alteraciones centrales de la presbiacusia afectan a los centros y sus conexiones, lo que conlleva una serie de modificaciones psicológicas y comportamentales (Cooper y cols., 1974), el aislamiento y la discapacidad percibida por el paciente (Resnick y cols., 1997), al tiempo que afectan a los mecanismos centrales de la discriminación auditiva. En estos últimos destacan los problemas de localización de la fuente de sonido y del procesamiento de sonidos complejos como el lenguaje (Zhong y cols., 2012), así como la pérdida de inteligibilidad del lenguaje hablado (Schuknecht y Gacek, 1993). Por estos motivos, entre otros sociales y sanitarios, el estudio de la presbiacusia central tiene un interés creciente, tanto desde un punto de vista clínico como para la investigación básica. Es muy relevante poder arrojar la suficiente luz sobre su etiología y sus características, sobre todo en cuanto a la correlación entre las alteraciones seniles del procesamiento auditivo con las concomitantes disfunciones cognitivas (Gates, 2012).
Distinguir los efectos del envejecimiento auditivo de otras hipoacusias puede ser complejo si no se cuenta con algunas pruebas funcionales que apoyen el diagnóstico. Por otra parte, puede ser muy difícil separar los efectos centrales derivados de una lesión primaria del receptor auditivo periférico de aquellos que surgen de la alteración de procesamiento del propio receptor auditivo. Una prueba diagnóstica adecuada puede ser el estudio de los potenciales evocados auditivos de tronco cerebral (PEATC), sobre todo porque no se ven afectados por otras alteraciones concomitantes, de memoria o atención, entre otras (Konrad-Martin y cols., 2012). Los PEATC constituyen una herramienta simple y útil para evaluar la presbiacusia en humanos (Boettcher, 2002) y también en modelos animales (Castillo y cols., 2006). Las modificaciones que se detecten tanto en el umbral, la latencia y la amplitud de los PEATC serán fiel reflejo de las alteraciones del nervio periférico y de los núcleos auditivos ubicados en el tronco cerebral (Burkard y Sims, 2001). En los PEATC se ha detectado, tanto en modelos experimentales (Castillo y cols., 2006) como en humanos (Konrad-Martin y cols., 2012), de manera homogénea, una reducción de la amplitud de las ondas que se incrementa con la edad. También se ha observado un alargamiento progresivo de la latencia de las ondas y de los intervalos entre ellas (figura 3). Tanto en animales (Castillo y cols., 2006) como en humanos (Burkard y Sims, 2001), la alteración más importante de los PEATC que se vincula al proceso de envejecimiento es la reducción de la amplitud de la onda I (figura 3), lo que coincide con una modificación similar en el potencial de acción compuesto del nervio auditivo (PAC). La diferencia es mucho más importante que la que se aprecia, por ejemplo, en latencia de la onda V (Burkard y Sims, 2001; Konrad-Martin y cols., 2012) que, en cualquier caso, muestra una diferencia muy escasa, pero significativa en los ancianos frente a los adultos jóvenes.
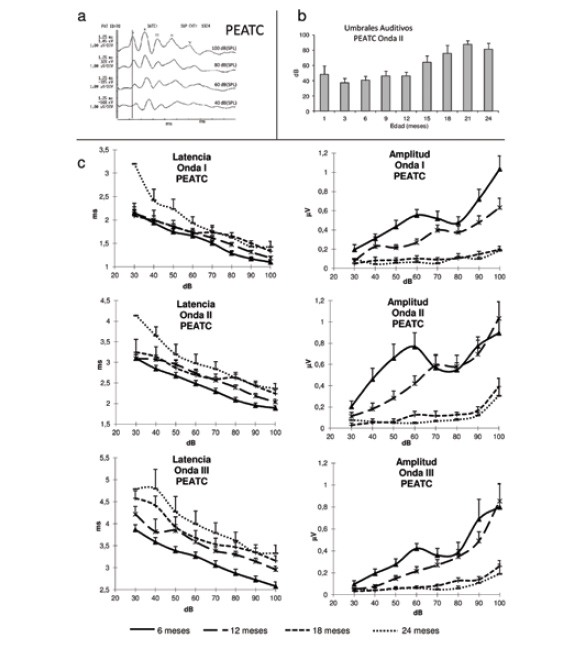
Figura 3.
El Potencial Evocado de Tronco Cerebral (PEATC) en un modelo experimental de presbiacusia. El registro del PEATC en el ratón de la cepa C57/BL6j a diferentes edades permite el estudio de las características electrofisiológicas de la sordera del envejecimiento en estos animales. a) Registro del PEATC en un animal normoyente. La disminución de la intensidad del estímulo hace que aumente la latencia de las cinco ondas del PEATC (I-V) y que disminuya su amplitud. En roedores, la onda de referencia para la determinación del umbral auditivo con los PEATC es la onda II, que es la que más amplitud alcanza y, por lo tanto, la última que se pierde al disminuir la intensidad del estímulo. b) Progresión del umbral auditivo a lo largo de la vida del ratón C57/BL6j. Usando la onda II del PEATC como referencia de umbral auditivo se observa que, a partir de los 12 meses de edad, hay un aumento significativo del umbral auditivo hasta los 90 dB, aproximadamente a partir de los 21 meses. c) Evolución de la latencia y de la amplitud de las ondas del PEATC a lo largo del tiempo. Se exponen como ejemplo las ondas I, II y III, en las que se puede observar el paulatino incremento de la latencia de estas ondas y una reducción de su amplitud en las diferentes intensidades de estímulo en perfecta correlación con el envejecimiento de los animales.
Estas modificaciones del procesamiento central del mensaje auditivo en la presbiacusia de tipo central pueden deberse a posibles pérdidas neuronales en el tronco cerebral, que también podrían producirse en las partes altas de la vía. No obstante, este tipo de presbiacusia central, más que a una amplia pérdida neuronal, parece afectar sobre todo al procesamiento de los haces y fascículos neurales de tipo modulador (inhibidor); y esto sería cierto para todos los niveles nucleares de la vía auditiva. En concreto, se verían afectadas las neuronas inhibidoras de tipo GABAérgico como han demostrado estudios recientes (Martín del Campo y cols., 2012). Se suelen asociar cambios degenerativos difusos del SNC, como pérdida de sustancia blanca y gris, que se manifiestan con debilidad, incoordinación, amnesia, temblor y deterioro intelectual (Armstrong y cols., 1992).
Efectos del envejecimiento en los núcleos de la vía auditiva en el tronco cerebral
El envejecimiento provoca la pérdida de neuronas periféricas que suponen una inevitable deaferentación crónica de los núcleos cocleares, que son la estructura diana del nervio auditivo (figura 2) (Arnesen 1982; Chisolm y cols., 2003). Uno de los primeros efectos de esa deaferentación, o del envejecimiento en sí mismo, es la pérdida de neuronas en los núcleos cocleares (figura 2) y de sus proyecciones hacia la vía auditiva (Frisina y Walton, 2006). Esta reducción progresiva del número de neuronas de los núcleos cocleares vinculada al envejecimiento puede llegar a ser del 40% o más del total de células (Arnesen, 1985). Además, se produce un descenso de la actividad neuroquímica generalizada en las neuronas de los núcleos cocleares dorsal y ventral (Caspary y cols., 2008). La reducción de expresión de glicina (comprobada bioquímicamente) en los núcleos cocleares conlleva la reducción de la actividad moduladora (de la inhibición) y, por tanto, un incremento de las tasas de descarga de las neuronas de los núcleos cocleares (Frisina y Walton, 2006). Estos procesos de envejecimiento modifican la actividad funcional de estas neuronas de los núcleos cocleares y alteran la percepción de intensidad sonora y la codificación temporal de la señal (Caspary y cols., 2008).
En cualquier caso, como la pérdida de elementos neuronales es lenta y progresiva, se ponen en marcha mecanismos compensatorios sobre las neuronas de dichos núcleos (Caspary y cols., 2008); se trata de una serie de mecanismos de plasticidad neural bien conocidos en las lesiones del nervio auditivo o de la cóclea (Gil-Loyzaga, 2007, 2009, 2011; Gil-Loyzaga y cols., 2009, 2010). Estos sistemas de plasticidad neural, en lesiones sensoriales crónicas que no provoquen la deaferentación total, pueden activar mecanismos sinápticos compensatorios que permitan que la actividad se mantenga en unos límites funcionales aceptables (Rich y Wenner, 2007). Lo que se ha demostrado como muy importante es la reducción de los sistemas de modulación (inhibitorios) de la señal aferente, especialmente de los sistemas GABAérgicos (Caspary y cols., 2008), que hacen que las capacidades de filtrado de dicha señal se vean muy reducidas. Esta situación también ha sido observada en el sistema auditivo en las fibras del sistema olivococlear eferente (haz de Rasmussen), que desde el complejo olivar proyecta sobre las fibras aferentes directamente en la cóclea (Bartolomé y cols., 2009). La reducción de esa protección podría redundar en un fenómeno neurodegenerativo endógeno debido a la neurotoxicidad inducida por el propio glutamato que, en condiciones fisiológicas y bajo la modulación adecuada, sería el responsable del paso de la información hacia el nervio auditivo.
Aunque está claro que la mayor alteración está vinculada a la lesión periférica del receptor, no hay que descartar las lesiones concomitantes a lo largo de la vía auditiva. En los núcleos cocleares, por ejemplo, la reducción del número de fibras procedentes del receptor periférico (figura 1 y 2) puede afectar de forma significativa a la capacidad de discriminación temporal de los diferentes inputs (Konrad- Martin y cols., 2012). Pero, en realidad, para que la pérdida de neuronas suponga una desorganización significativa del análisis de los sonidos complejos en las partes altas del tronco cerebral, se requiere que la degeneración sea crónica, ya que en los momentos iniciales, y de menor afectación, los procesos de plasticidad neural podrían ser suficientes para compensar la pérdida de actividad.
Las lesiones no se restringen a los núcleos cocleares, sino que afectan a otras regiones de la vía auditiva. Ya se ha mencionado que en nuestro laboratorio hemos identificado la reducción sináptica de las proyecciones del complejo olivar superior en el receptor auditivo (Bartolomé y cols., 2009). La pérdida de neuronas implicadas en los sistemas de inhibición sináptica (especialmente tipo GABAérgico) en el complejo olivar superior y en el colículo inferior (hasta un 36% de las células activas según Caspary y cols. (1990), y vinculada a la alteración de los núcleos cocleares, provoca una reducción notable de la capacidad de localizar la fuente sonora en el espacio (Caspary y cols., 2008). Asimismo, esta reducción en los sistemas de filtrado de la señal sonora provocan un aumento de la actividad espontánea de las neuronas de los núcleos de la vía, lo que funcionalmente se traduce en un aumento del ruido neural y, por tanto, en anomalías en la percepción acústica.
Los efectos del envejecimiento en el colículo inferior van a tener una gran trascendencia en la localización espacial de la fuente sonora, en tanto que una de las misiones principales de este núcleo es precisamente identificar el origen del sonido. El colículo inferior es una de las estructuras más complejas de la vía auditiva, lo que se manifiesta a través de una compleja estructura de células y circuitos implicados ampliamente en el análisis del mensaje auditivo (Sánchez Malmierca y Merchán Cifuentes, 2007). Entre los procesos en los que participa el colículo inferior hay que destacar: el análisis binaural y la localización de la fuente de sonido, la modulación de la frecuencia y amplitud de la señal percibida, la detección de intervalos, la identificación de vocalizaciones específicas de cada especie, etc. (Walton, 2010). Durante el envejecimiento se ha observado que las neuronas de los núcleos altos del tronco cerebral implicados en la vía auditiva (colículo inferior, cuerpo geniculado medial, etc.) pueden presentar cambios degenerativos, que afectan especialmente a neuronas de función inhibidora (GABAérgicas, etc.) (Caspary y cols., 1990, 2008).
Efectos del envejecimiento sobre la corteza cerebral auditiva
La corteza auditiva participa en todos los procesos de percepción, interpretación y análisis de las señales sonoras y, muy especialmente, en los sonidos complejos, como el lenguaje (Gil-Loyzaga, 2005). Está organizada según un patrón espacial y citoarquitectural muy preciso (Gil-Loyzaga, 2005; Sánchez Malmierca y Merchán Cifuentes, 2007) en el cual se identifican múltiples campos de actividad input/output con una alta selectividad de respuesta (Martín del Campo y cols., 2012). La corteza auditiva primaria (A1), en todos los mamíferos, incluido el ser humano, cuenta con un mapa tonotópico procedente de ambos oídos que proyecta sobre ambos hemisferios, gracias a las comisuras de la vía auditiva (Gil-Loyzaga, 2005; Sánchez Malmierca y Merchán Cifuentes, 2007). Por este motivo, todas las neuronas corticales auditivas son binaurales, ya que reciben información complementaria de ambos oídos. Las neuronas de la corteza auditiva se encuentran organizadas funcionalmente en columnas excitatorias e inhibitorias que permiten un filtrado adecuado de la señal sonora percibida periféricamente. Por su parte, la actividad del córtex auditivo secundario (AII) se reconoce como especialmente compleja (Gil-Loyzaga, 2005; Sánchez Malmierca y Merchán Cifuentes, 2007), aunque es notorio que participa en el análisis de patrones complejos, en el procesamiento temporal de los mismos, en el intercambio sensorial polimodal, etcétera.
En modelos animales se ha detectado una pérdida progresiva, relacionada con la edad, de la actividad de las neuronas corticales, en concreto las de tipo parválbumina- GABAérgicas (figuras 4 y 5), implicadas en la modulación cortical rápida de los mensajes vocales (Martín del Campo y cols., 2012) y en la formación del componente inhibitorio (de filtrado) de los campos auditivos corticales (Ouda y cols., 2008). Es de reseñar que la reducción o ausencia de expresión de parvalbúmina (identificada en la corteza auditiva durante el envejecimiento) no se corresponde con una verdadera pérdida del número de neuronas sino de su actividad (Caspary y cols., 2008). Por otra parte, tiene una relación directa con la capa cortical afectada, que es más importante en las capas I a IV (figura 5) que en las V y VI. Esto indica claramente que el envejecimiento afecta de manera específica a determinadas neuronas (Martín del Campo y cols., 2012).
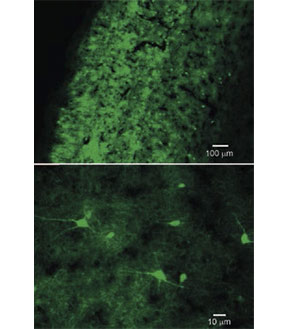
Figura 4.
Detección inmunohistoquímica de la expresión de parvalbúmina en neuronas de la corteza auditiva del ratón C57BL6J, un modelo experimental de envejecimiento del receptor auditivo ampliamente utilizado.
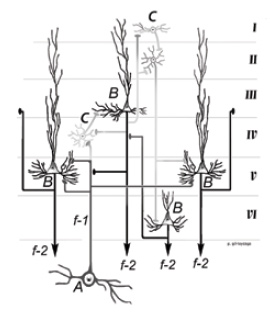
Figura 5.
Esquema de la corteza cerebral auditiva en la que las neuronas C (granos) de tipo modulador GABAérgico que expresan parvalbúmina han reducido su actividad (representadas en gris claro). Esta situación implica una modificación drástica en los procesos de filtrado de señal y de la modulación de la actividad de las neuronas piramidales (B). A = neuronas del cuerpo geniculado medial (CGM) que proyectan sobre la corteza auditiva. f-1= fibras aferentes a la corteza desde el CGM. f-2 = fibras eferentes o axones de las neuronas piramidales (Interpretación personal a partir del trabajo Gil-Loyzaga, 2005; y de Martín del Campo y cols., 2012).
La presbiacusia, a nivel cortical, no sería una alteración difusa indeterminada sino que afectaría, sobre todo, a los sistemas de modulación y regulación de la señal auditiva. Son precisamente este tipo de alteraciones las que se ponen de manifiesto en el envejecimiento. Sobre el área A1 se ha observado una reorganización de circuitos en los modelos experimentales de animales con lesiones en bandas concretas de frecuencias (Caspary y cols., 2008). Este proceso afecta al análisis de frecuencias discretas, pero sobre todo a la percepción de patrones frecuenciales en sonidos complejos, por lo que se pierde capacidad de discriminación. Los efectos del envejecimiento sobre el área AII son mucho más complejos, pero, por ejemplo, la pérdida de análisis polimodal y de patrones justifica el que, en el envejecimiento, se pierda en buena medida la capacidad de incorporación de nuevos fonemas, y que se dificulte la comprensión de algunos conocidos. Por su parte, la alteración del procesamiento interhemisférico y del intercambio de información entre regiones homónimas podrían justificar los problemas de comprensión del mensaje lingüístico en los ancianos (Martin y Jerger, 2005).
La estimulación (el entrenamiento) ha demostrado que es un factor preventivo de la pérdida de actividad de las neuronas que expresan parvalbúmina (figura 4) (De Villers-Sidani y cols., 2010). Por tanto, la pérdida de neuronas periféricas, ampliamente demostrada en modelos experimentales de presbiacusia (Gil- Loyzaga, 2002; Castillo y cols., 2006), supone la reducción de inputs ascendentes hacia la corteza y por tanto quedaría justificada la reducción de actividad de las neuronas moduladoras, con lo que se justifica, entre otros muchas alteraciones de la vía auditiva, la pérdida de inteligibilidad propia de esta patología. Lo que se revela muy importante es que los sistemas inhibitorios parecen ser más sensibles a los procesos de envejecimiento, al menos en el sistema auditivo (Martín del Campo y cols., 2012). La vulnerabilidad de estos sistemas estaría vinculada al estrés oxidativo (Powell y cols., 2012), lo cual se relaciona con alteraciones mitocondriales y una progresiva reducción de la actividad citocromo-oxidasas en el córtex auditivo durante el envejecimiento (Zhong y cols., 2012).
Conclusiones
El envejecimiento provoca modificaciones relevantes en la vía auditiva. En concreto afecta a los núcleos neuronales (por reducción del número de células y su actividad funcional), a los haces de fibras activadoras ascendentes que vehiculizan la señal hacia la corteza, pero muy especialmente a los sistemas moduladores (inhibidores) descendentes e intranucleares encargados del filtrado de la señal. Este tipo de lesiones, pre y postsinápticas, de los sistemas moduladores son comunes a todos los sistemas sensoriales. De hecho, son responsables de las pérdidas de precisión y sensibilidad en los mismos, que son propias del envejecimiento. Aunque se pueden identificar fenómenos de plasticidad neural, como en otras lesiones auditivas, no tienen porque ser favorables a la mejora del establecimiento del procesamiento de la señal. Un avance en el estudio de la etiología y fisiopatología de la presbiacusia central, de sus métodos de diagnóstico y terapéuticos, puede permitir la detección precoz de esta patología. Con ello, se podría evitar un progresivo deterioro auditivo y, sobre todo, la aparición de alteraciones cognitivas, comportamentales y psicológicas asociadas que agraven el cuadro de deterioro en la comunicación del sujeto anciano.
Bibliografía
- Notestein, F. «Some demographic aspects of aging». Proc. Am. Philosophical Soc., 1954:98:38-45
- Alvarez Perelló, E.A. «Últimas estadísticas de la población mundial por las Naciones Unidas». Geriátrika, 2001:17/6:231-3.
- Gil-Loyzaga , P.; Gil Pérez, D. «Present and evolution of the Spanish society: information and communications technologies applied to the Health System. Nomads» (Critical Review of Social and Juridical Sciences). Mediterranean Perspectives, 2009:1: 221-41.
- Gaullier, X. Le temps des retraites, les mutations de la société salariale. Paris: Ed. Seuil. Collección «La République des Idées», 2003. Pág. 95.
- Jazwinsk i, S.M. «Genetics on longevity». Exp. Gerontol., 1998:33:773-83.
- Nag ley, P.; Wei, Y.H. Aging and mammalian mitochondrial genetics. Trends in Genetics, 1998:14:513-7.
- Mora, F.; Segovia, G.; del Arco, A. «Envejecimiento cerebral». En: Fisiología Humana, 4.ª ed., J.A.F. Tresguerres. Edit. McGraw Hill-Interamericana, 2010;94:1192-9.
- Gil-Loyzaga , P. «Neuroplasticidad y sistema auditivo». Tratado de otorrinolaringología y cirugía de cabeza y cuello. Editores: C. Suárez, L. M. Gil-Carcedo, J. Marco, J. Medina, P. Ortega, y J. Trinidad. Edit. Panamericana, 2007. Tomo 2 (2.ª edición). Págs. 1057-65.
- Gil-Loyzaga , P. «Biological bases of neuroplasticity: in vivo and in vitro studies. Interest for the auditory system ». Audiological Medicine, 2009:7/1:2-10.
- Gil-Loyzaga , P.: «Plastic change in central auditory system after hearing loss. En: Neuroplasticity in the Auditory Brainstem». From Physiology to the Drug Therapy. Ed. Angelo Salami. Edit. Nova Biomedical Science Publishers Inc., 2011. Capítulo 4, págs. 45-63.
- Gil-Loyzaga , P.; Iglesias , M.C.; Carricondo, F.; Bartolome, M.; Rodríguez, F.; Poch-Broto, J. «Cochlear nuclei neuroplasticity after auditory nerve and cochlea removal ». Audiological Medicine, 2009:7/1:29-39.
- Gil-Loyzaga , P.; Carricondo, F.; Bartolome, M.; Iglesias , M.C.; Rodríguez, F.; Poch-Broto, J. «Cellular and molecular bases of neuroplasticity: brainstem effects after cochlear damage». Acta Otolaryngol (Stockh.), 2010:130/3:318-25.
- Caspa ry, D.M.; Ling, L.; Turner, J.G.; Hugh es, L.F. «Inhibitory neurotransmission, plasticity and aging in the mammalian central auditory system». J. Exp. Biol., 2008:211:1781-91.
- Gates, G.A.; Mills, J.H. «Presbycusis». The Lancet, 2005:366:1111-20.
- Resnick, H.E.; Fries, B.E.; Verbrugg e, L.M. «Windows to the world: The effect of sensory impairments on social engagement and activity time in nursing home residents». J. Gerontol., 1997:52B:S135-S144.
- Zarit, S.H.; Knigh t, B.G. A guide to psychotherapy and aging: effective clinical interventions in a life-stage context. Washington D. C.: Zarit, S. H.; Knight, B. G. (Eds.). American Psychological Association, 1996.
- Katzman, R. «Normal aging and the brain». New Psysiol. Sci., 1988:3:197-200.
- Selkoe, D.J. «The molecular pathology of the Alzheimer´s disease». Neuron, 1991:6: 487-98.
- Schuknecht; H.F.; Gacek, M.R. «Cochlear pathology in presbycusis». Ann. Otol. Rhinol. Laryngol., 1993:102:1-16.
- Ciges, M.; Fernández, F.; Cortés, R. «Presbiacusia». En: Tratado de otorrinolaringología y cirugía de cabeza y cuello. Guadalajara: Ed. Proyectos Médicos S. L., Tomo II, parte III, 1999:100:1395-405.
- Martín del Camp o, H.N.; Meas or, K.R.; Razak , K.A. «Parvalbumin immunoreactivity in the auditory cortex of a mouse model of presbycusis». Hearing Res., 2012:294:31-9.
- Willott, J.F.; Chisolm, T.H.; Lister, J.J. «Modulation of Presbycusis: Current status and future directions». Audiol. Neurootol., 2001:6:231-249.
- Seidma n, M.D. «Effects of Dietary Restriction and Antioxidants on Presbyacusis». The Laryngoscope, 2000:110:727-738.
- Gates, G. A.; Myers, R. H. «Genetic associations in age related hearing thresholds». Arch. Otolaryngol. Head Neck Surg., 1999:125/6:654–9.
- Patterson, J.V.; Micha lewsk y, H.J.; Thomps on, L.W.; Bowma n, T.E.; Litzelma n, D.K. «Age and sex differences in the Human Auditory Brainsten Response». J. of Gerontology, 1981:36 (4):455-462.
- Ensink, R.J.; Camp , G.V.; Cremers, C.W. «Mitochondrial inherited hearing loss». Clin. Otolaryngol. Allied Sci., 1998:2371:3–8
- Weinstein, B.E. Geriatric Audiology. New York: Thieme, 2000. Págs. 99-101.
- Howarth, A.; Shone, G.R. «Ageing and the auditory system » Postgrad. Med. J. 2006:82/965:166–71.
- Gates, G.A. «Central auditory processing in presbycusis: an epidemiological perspective». En: Hearing Care for Adults, 2009. Págs. 47-52.
- Jennings , C.R.; Jones, N.S. «Presbyacusis». J. Laryng. Otol., 2001:115:171-8.
- Proupín Vázquez, N.; Lorenzo Martínez, A.; del Río Valeiras , M.; Álvarez Alonso, L.; Segad e Buceta, X.; Labella Caballero, T. «Propuesta de cribado de la presbiacusia en una consulta de atención primaria». Aten. Primaria, 2007;39/1:35-40.
- Schuknecht, H.F. «Presbycusis». The Laryngoscope, 1955: 65/6: 402–19.
- Rivera, T. «Presbiacusia». En: Tratado de otorrinolaringología y cirugía de cxabeza y cuello. Editores: C. Suárez, L. M. Gil-Carcedo, J. Marco, J. Medina, P. Ortega, y J. Trinidad. Edit. Panamericana, Tomo 2 (2.ª ed). 2007. Págs. 1625-33.
- Gates, G.A. «Central presbycusis: an emerging view». Otolaryngol. Head Neck Surg., 2012:147/1:1-2.
- Humes, L.E.; Dubno, J.R.; Gordon-Salant, S.; Lister, J.J.; Cacace, A.T.; Cruicksha nks , K.J.; Gates, G.A.; Wilson, R.H.; Wingf ield, A. «Central presbycusis: a review and evaluation of the evidence». J. Am. Acad. Audiol., 2012:23/8:635-66.
- Arnesen, A.R. «Presbycusis; loss of neurons in the human cochlear nuclei». J. Laryngol. Otol., 1982:96:503-11.
- Pichora-Fuller, M.K.; Souza, P.E. «Effects of aging on auditory processing of speech». Int. J. Audiol., 2003. 422S11–2S16.
- Suga , F.; Lindsa y, J.R. «Hitopathological observations of presbycusis». Ann. Otol., 1976:85:169-85.
- Arnesen, A.R. «Numerical estimations of structures in the cochlear nuclei and cochlear afferents and efferents ». Acta Otolaryngol., 1985:Suppl. 423:81-4.
- Chisolm, T.H.; Willott, J.F.; Lister, J.L. «The aging auditory system: anatomic and physiologic changes and implications for rehabilitation». Int. J. Audiol., 2003:42: Suppl. 2 S3–10.
- Castillo, E.; Carricondo, F.; Bartolomé, M.V.; Vicente, A.; Poch-Broto, J.; Gil-Loyzaga , P. «Presbiacusia: degeneración neuronal y envejecimiento en el receptor auditivo del ratón C57/BL6J». Acta Otorrinolaringológica Española, 2006:57:383-387.
- Gil-Loyzaga , P. «Sordera y envejecimiento: Estudios en modelos experimentales». Anales Real Acad. Medicina y Cirugía, 2002:119/2:273-88.
- Bao, J.; Ohlemiller, K.K. «Age-related loss of spiral ganglion neurons». Hearing Research, 2010:264:93–7.
- Luxon, L.M. «The anatomy and pathology of the central auditory pathways». Br. J. Audiol. 1981:15:31–40.
- Pujol, R.; Puel, J.L. «Excitotoxicity, synaptic repair, and functional recovery in the mammalian cochlea: A review of recent findings». Ann. N. Y. Acad. Sci., 1999:884:249-54.
- Gil-Loyzaga , P. «Estructura y función de la corteza auditiva. Bases de la vía auditiva ascendente». En: Tratado de audiología. Editores: E. Salesa Valle, E. Perelló Scherdel, A. Bonavida Estupiñá. Barcelona: Editorial Masson (Elsevier), 2005. Capítulo 2, págs. 23-38.
- Gil-Loyzaga , P.; Poch Broto, J. «Anatomía e Histología de la Cóclea». En: Tratado de otorrinolaringología y cirugía de cabeza y cuello. Editores: C. Suárez, L. M. Gil- Carcedo, J. Marco, J. Medina, P. Ortega, y J. Trinidad. Edit. Panamericana. Tomo 2 (2ª ed), 2007. Págs. 867-78.
- Gil-Loyzaga , P.; Pujol, R. «Fisiología del receptor y la vía auditiva». En: Fisiología Humana, 4.ª ed. J. A. Tresguerres. Edit. McGraw Hill-Interamericana, 2010;16:227-39.
- Pocock, G.; Richards , C.D. Human physiology: the basis of medicine. Oxford (UK): Oxford University Press, 1999. Págs. 131–6.
- Mas oro, E.J. «Animal models in aging research». En: Handbook of the Biology of Aging. Eds: E. L. Schneider, J. W. Rowe. N. Y.: Academic Press Inc., 1990. Págs. 72-93.
- Bartolomé, M.V.; Zuluaga , P.; Carricondo, F.; Gil-Loyzaga , P. «Immunocytochemical detection of synaptohysin in C57bl/6 mice cochlea during aging process». Brain Research Reviews, 2009:60:341 - 348.
- Atencio, C.A.; Schreiner, C.E. «Spectrotemporal processing differences between auditory cortical fastspiking and regular-spiking neurons». J. Neurosci., 2008:28:3897-910.
- Welsh, L.W.; Welsh , J.J.; Healy, M.P. «Central presbycusis ». Laryngoscope, 1985:95:128-36.
- Stach, B.; Spretnjak , M.; Jerger. J. «The prevalence of central presbycusis in a clinical population». J. Am. Acad. Audiol., 1990:1:109-15.
- Cooper, A.F.; Curry, A.R.; Kay, D.W.K.; Garside, R.; Roth, M. «Hearing loss in paranoid and effective psychosis of the elderly». Lancet, 1974:7885: 851-4.
- Zhong, Y.; Hu, Y.; Peng, W.; Sun, Y.; Yang, Y.; Huang, X.; Zha ng, H.; Kong, W. «Age-related decline of the cytochrome c oxidase subunit expression in the auditory cortex of the mimetic aging rat model associated with the common deletion». Hearing Res., 2012:294/1-2:40-8.
- Konrad -Martin, D.; Dille, M.F.; McMillan, G.; Griest, S.; McDermott, D.; Fausti, S.A.; Austin, D.F. «Age-Related Changes in the Auditory Brainstem Response». Am. Acad. Audiol., 2012:23:18–35.
- Boettcher, F.A. «Presbyacusis and the auditory brainstem response». J. Speech Lang. Hear. Res., 2002:45/6:1249-61.
- Burkard, R.F.; Sims, D. «The human auditory brainstem response to high click rates: aging effects». Am. J. Audiol., 2001:10/2:53-61.
- Arms trong, D.; Stoney, P.; Hawk e, M.; Farkash idy, J. «Presbycusis: Correlations of clinical audiology with morphological changes in the cochlea and the ventral cochlear nucleus». J. Otolaryngology, 1992:21:343-9.
- Frisina, R.D.; Walton, J.P. «Age-related structural and functional changes in the cochlear nucleus». Hear Res., 2006:216/217:216-23.
- Rich, M.M.; Wenner, P. «Sensing and expressing homeostatic synaptic plasticity». Trends Neurosci., 2007:30,119-25.
- Caspa ry, D.M.; Raza, A.; Lawh orn, B.A.; Pipp in, J.; Arneric, S.P. «Immunocytochemical and neurochemical evidence for age related loss of GABA in the inferior colliculus: Implications for neural Presbycusis». J. Neurosci., 1990:10/7:2363-72.
- Sánchez Malmierca, M.; Merchán Cifuentes, M.A. «Estructura y función del cerebro auditivo». En: Tratado de otorrinolaringología y cirugía de cabeza y cuello. Editores: C. Suarez, L. M. Gil-Carcedo, J. Marco, J. Medina, P. Ortega, y J. Trinidad. Edit. Panamericana, 2007. Tomo 2 (2.ª edición). Págs. 969-96.
- Walton, J.P. «Timing is everything: Temporal processing deficits in the aged auditory brainstem» Hearing Res., 2010:264:63–9.
- Ouda , L.; Druga , R.; Syka , J. «Changes in parvalbumin immunoreactivity with aging in the central auditory system of the rat». Exp. Gerontol., 2008:43:782-9.
- Martin, J.S.; Jerger, J.F. «Some effects of aging on central auditory processing». J. Rehabil. Res. Dev., 2005:42/4 (Supp 2):25-44.
- de Villers-Sida ni, E.; Alzgh oul, L.; Zhou, X.; Simps on, K.L.; Lin, R.C.; Merzenich, M.M. «Recovery of functional and structural age-related changes in the rat primary auditory cortex with operant training». Proc. Natl. Acad. Sci. (USA), 2010:107:13900-05.
- Powell, S.B.; Sejnowsk i, T.J.; Behrens, M.M. «Behavioral and neurochemical consequences of cortical oxidative stress on parvalbumni-interneurons maturation in rodent models of schizophrenia». Neuropharmacology, 2012:62:1322-31.

